표준담배추출물과 Lipopolysaccharide로 유발한 만성폐쇄성폐질환 동물모델에서 쌍화탕의 폐손상 및 근감소 억제 효과
Inhibitory Effects of Ssanghwa-tang on Lung Injury and Muscle Loss in a Cigarette Smoke Extract and Lipopolysaccharide-induced Chronic Obstructive Pulmonary Disease Mouse Model
Article information
Abstract
ABSTRACT
Objectives:
This study evaluated the effects of Ssanghwa-tang (SHT) on lung injury and muscle loss in a COPD mouse model.
Methods:
C57BL/6 mice were challenged with cigarette smoke extract and lipopolysaccharide, and then treated with two concentrations of SHT (250 and 500 mg/kg). After sacrifice, the bronchoalveolar lavage fluid (BALF) or lung tissue was analyzed by cytospin, ELISA, real-time PCR, flow cytometry analysis, and H&E and Masson’s trichrome staining. The grip strength of COPD mice was measured using a grip strength meter. The running time of COPD mice was measured by a treadmill test. Muscle tissue of the quadriceps was stained with H&E and Masson’s trichrome staining.
Results:
SHT significantly inhibited the increase in neutrophil numbers in BALF and significantly decreased immune cell activity in BALF and lung tissue. It also significantly inhibited the increase in TNF-α, IL-17, and MIP2 in BALF. Real-time PCR analysis revealed that the mRNA expression of TNF-α, IL-17, MIP2, and TRPV1 in lung tissue showed a significant decrease compared with the control group. Lung tissue damage was significantly reduced in the histological analysis. The grip strength and running time of the COPD mice showed a significant decrease compared with the control group. In histological staining, SHT was found to reduce the damage to muscle tissue.
Conclusions:
This study indicates that SHT can be used as a therapeutic agent for COPD patients by inhibiting lung injury and muscle loss.
I. 서 론
만성폐쇄성폐질환(Chronic Obstructive Pulmonary Disease, COPD)은 담배연기와 같은 유해 입자나 가스의 흡입 및 감염 등으로 인한 기도와 폐실질(lung parenchyma)의 이상에 의하여 지속적인 호흡기 증상과 점차 진행하는 기류제한을 나타내는 질환이다1. COPD의 특징인 비가역적 기류 제한과 가스교환의 장애는 만성 염증, 점액의 과분비 및 섬유화에 의하여 소기도의 협착과 폐 실질의 파괴와 같은 구조 변화의 결과로 발생하며 호흡곤란과 가래를 동반한 만성 기침과 같은 호흡기 증상을 초래한다2.
이와 같이 COPD는 장기간 흡연하거나 위험인자에 노출되었던 사람이 중년 또는 고령이 되어 발생하므로 주로 폐에 영향을 미칠 뿐만 아니라 한편으로는 체중 감소, 영양 상태 불균형, 골격근육의 기능 저하 등 호흡기 이외의 전신적 증상을 나타내게 된다3. 특히 나이가 증가함에 따라 근육의 양(muscle mass)과 근력(strength) 또는 근 기능(muscle function)이 모두 감소하는 근감소증이 쉽게 진행된다4. COPD 환자에서 호흡 골격근의 기능적, 대사적, 근조직학적 변화는 흉벽의 리모델링을 유발하고 결국 급성 악화와 악순환 고리를 형성하여 운동능력과 삶의 질을 떨어뜨리고 불량한 예후에 기여하게 된다5. 따라서 COPD의 장기적 관리를 위해서는 호흡기 병리기전의 억제와 더불어 근육 기능저하를 교정하는 것이 중요한 역할을 할 수 있다.
COPD에 대한 한의 처방의 효과를 평가한 기존 연구를 변증 분류6에 따라 살펴보면 풍한형(風寒型)의 소청룡탕7, 폐열형(肺熱型)의 과루행련환 유래 GHX028, 담탁형(痰濁型)의 사간탕 유래 SGX019, 폐허형(肺虛型)의 감길탕 유래 GGX10, 신음허형(腎陰虛型)의 청상보하탕 유래 PM01411 등이 있었으나 COPD에 병발하는 근감소에 대한 영향을 동시에 평가한 연구는 찾기 어려웠다.
쌍화탕(雙和湯)은 ≪동의보감(東醫寶鑑)≫12에서 정신과 신체가 피로하고 기혈이 모두 손상되었을 때 사용하는 것으로 기재된 처방으로 사물탕(四物湯)과 황기건중탕(黃耆建中湯)의 합방으로 구성되어 있으며13, 항피로14, 면역활성화15에 대한 효능 연구와 운동수행능력16, 만성피로17 등의 임상연구가 있다. 이와 같은 처방구성과 선행 효능에 근거하여 쌍화탕이 근감소가 동반되는 COPD의 치료에 적용 가능할 것으로 판단되었다.
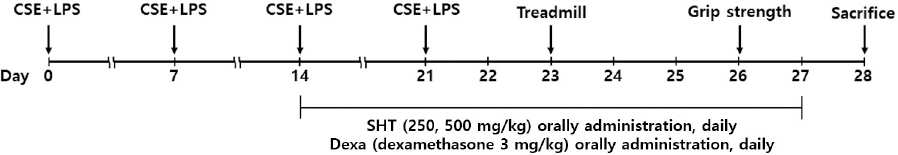
이에 저자는 쌍화탕의 COPD로 인한 폐손상과 근감소에 대한 억제 효과를 실험적으로 확인하고자 하였다. 실험은 표준담배추출물(Cigarette Smoke Extract, CSE)과 Lipopolysaccharide(LPS)로 유발한 COPD 동물모델14을 이용하여 폐조직과 기관지폐포 세척액(Bronchoalveolar lavage fluid. 이하 BALF)에서 총 세포수를 측정하였고, 관련 cytokines를 enzyme-linked immunosorbent assay(이하 ELISA)로 분석하였으며, 면역세포에 대한 영향을 fluorescence -activated cell sorting(이하 FACS)으로 측정하였고, 연관 유전자의 발현 정도를 real-time polymerase chain reaction(이하 RT-PCR)으로 측정하였으며, 폐조직 손상 억제 작용은 폐 생검을 통해 평가하였고, grip strength를 통해 근력을 평가하였으며, treadmill을 이용하여 근지구력을 측정하였고, 근위축 억제 작용을 대퇴사두근 생검을 통해 평가하여 유의한 효과를 확인하였기에 보고하는 바이다.
II. 재료 및 방법
1. 재 료
1) 약 재
실험에 사용한 쌍화탕(Ssanghwa-tang, SHT)의 구성약물은 대전한약국(Daejoen, Korea)에서 구입하였으며 1첩의 구성과 용량은 Table 1과 같다. 쌍화탕 500.0 g에 약재의 10배에 해당하는 증류수를 가하여 환류 추출기(Heating Mantle Stirrer analog, EAMS 9502-06, Seoul, Korea)를 이용하여 100~120 ℃에서 2시간 동안 추출하는 과정을 2회 실시하여 얻은 액을 여과하였다. 여과액을 감압 증류장치(rotary vacuum evaporator, Buchi B-480, Switzerland)로 농축한 다음, 동결 건조기(freezer dryer, Eyela FDU-540, Japan)로 완전히 건조한 후 냉동(-84 ℃) 보관하면서 사용하였다. 최종적으로 쌍화탕은 초기 약재 500.0 g으로부터 50.4 g의 추출물을 얻어 10.08%의 수율을 나타냈다.
2) 시약 및 기기
실험에 사용한 lipopolysaccharide(이하 LPS)는 Sigma사(USA)에서 구입하였고, 생리식염수에 용해시켜 1 mg/ml의 농도로 사용하였으며 사용 전까지 -20 ℃에서 보관하였다. 그 밖에 mouse TNF-α(tumor necrosis factor-α, R&D systems, USA), mouse IL-17(Interleukin-17, R&D systems, USA), mouse MIP2(Macrophage inflammatory protein 2, R&D systems, USA), 등을 사용하였다. FBS(Fetal Bovine Serum)는 Serum Source사(USA) 제품을, D-PBS(Dulbecco’s phosphate buffered saline), formaldehyde, DMEM, RPMI-1640 배양액은 Sigma사(USA) 제품을 사용하였고, 이외의 시약은 특급을 사용하였다.
기기는 열탕추출기(Daewoong, Korea), rotary vacuum evaporator(Buchi, Switzerland), freeze dryer (EYELA, Japan), CO2 incubator(Forma Scientific, USA), micro-pipet(Gilson, France), clean bench(Vision Scientific, Korea), autoclave(Sanyo, Japan), water bath(Vision scientific, Korea), Biosystem XA(Buxco Research System, USA), vortex mixer(Vision scientific, Korea), spectrophotometer(Shimazue, Japan), thermocycler system(MWG Biotech, Germany), deep-freezer(Sanyo, Japan), centrifuge(Sigma, USA), homogenizer(OMNI, USA), plate shaker(Lab-Line, USA), ELISA reader (Molecular Devices, USA), ice-maker(Vision scientific, Korea) 및 chemical balance(Cas, Korea) 등을 사용하였다.
2. 방 법
1) 동 물
실험에 사용한 동물은 C57BL/6 계열 생쥐(오리엔트바이오, Korea)로 수컷 7주령을 사용하였고, 고형 사료와 물의 섭취는 제한을 두지 않았다. 습도 50±10%와 온도 22~24 ℃가 유지되도록 하였고, 조명은 낮과 밤의 주기가 조절(12시간 주/야)이 되도록 하였으며, 실험 동물 몸무게의 평균은 24±4 g이었다. 대전대학교 동물실험윤리위원회에서 본 실험에 대하여 승인(승인번호: DJUARB2023-013)을 받은 다음 실험을 시행하였다.
2) Cigarette Smoke Extract(CSE)의 제조
(1) 표준담배 연소 및 연기 포집
최종적으로 선별된 연구로부터 저자, 출판연도, 연구 시행 국가, 실험 동물(종류, 연령, 체중), 실험군 및 대조군(각 군별 중재 및 용량, 각 군별 개체수), 미세먼지 모델 유발 방법(사용된 미세먼지 혹은 기타 물질, 투여 경로, 투여 기간), 한약 중재(종류, 투여 경로, 투여 기간), 평가 지표 및 연구 결과를 추출하였다. 표준담배로 사용된 Coresta Monitering Cigarette 7(Heinr. Borgwaldt, Germany)을 ISO3402 규정에 따라 온도 22±2 ℃ 및 상대습도 60±5%의 흡연공간에서 연소시켜 포집을 실시하였다. 자동흡연기(RM20/CS, Heinr. Borgwaldt, Germany)를 표준담배의 연소에 사용하였고, ISO3308 규정에 따랐다. 연소시간은 2.00±0.02초(기준: 꽁초 길이=tip paper 길이 3 mm)로 하였고, 흡연주기는 60±0.5초, 흡연 부피는 35.0±0.3 ml로 하였다. 연기 응축물의 포집은 92 mm 캠브리지 필터(cambridge filter, ISO3308 규격품, USA)를 사용하였다.
(2) 표준담배 연기응축물의 추출
자동흡연기의 cigarette holder에서 표준담배 연기가 포집된 캠브리지 필터를 분리하여 100 ml 크기의 삼각플라스크에 넣은 다음, isopropanol 50 ml을 첨가하여 흔들어서 잘 혼합한 후, 8시간 이상 실온에 방치하여 추출하였다. 추출 후 여과한 다음 감압여과 농축기를 이용하여 농축한 농축액을 Scintillation vial(03-340-25N, WHEATON, USA)에 담아 질소 가스를 이용하여 최종 농축하였다.
3) COPD 동물 모델 제작 및 약물 투여
7주령의 수컷인 C57BL/6 계열의 생쥐를 대상으로 표준담배 추출물(Cigarette smoke extract, CSE) 1 mg/ml와 LPS 100 μg/ml을 1:1로 혼합하여 1회 50 μl, 주 1회, 총 3주간 흡인시켜 COPD를 유발하였다. 먼저 7% Chloral hydrate(C8383, Sigma, USA)를 복강 주사하여 생쥐를 마취시킨 다음 CSE와 LPS의 혼합액을 기도로 투여하였다. 실험군은 유발을 위한 처리를 시행하지 않은 정상군(Normal, n=8), CSE와 LPS 혼합액을 투여한 대조군(Control, n=8), CSE와 LPS 혼합액을 투여하고 dexamethasone 3 mg/kg을 경구 투여한 양성대조군(Dexa, n=8), CSE와 LPS 혼합액을 투여하고 쌍화탕을 경구 투여한 실험군(SHT 250, 500 mg/kg, 각각 n=8)으로 나누었다. 약물의 투여는 2주 동안 매일 경구로 시행하였으며, 실험 종료 후 12시간 이상 절식한 상태에서 희생한 다음, 각 실험군의 생쥐에서 기관지폐포세척액(Bronchoalveolar lavage fluid, BALF), 폐조직(lung tissue), 근조직(muscle tissue)을 분리하였다.
4) 기관지폐포 세척액(BALF)의 분리
실험동물을 실험 최종일(28일 차)에 urethane으로 마취하여 채혈하고, 흉부를 열어 기도를 노출시킨 다음, 기관(trachea) 내에 주사기를 삽입하여 끈으로 묶어 고정시켰다. 주시기를 이용하여 FBS를 함유하지 않은 DMEM 배지 1 ml를 폐(lung) 안으로 3회 순환시켜 기관지폐포 세척액(BALF)을 얻었다. BALF를 4 ℃, 1,750 rpm의 조건으로 원심분리를 5분간 한 다음, 상층액은 cytokine에 사용하기 위해 별도로 냉동보관하였다. BALF에서 분리한 세포는 ACK 용액으로 3분간 처리하여 적혈구를 용해시키고, FBS를 함유하지 않은 DMEM 배양액으로 세척한 다음, hemocytometer로 총 세포수를 측정하였다.
5) BALF 중 총 neutrophils 수 측정
BALF를 대상으로 cytospin을 시행하여 neutrophils 수를 측정하였다. 먼저 침전을 통해 혈구를 분리하고, Diff-Quik staining을 3회 시행한 다음, PBS로 2회 세척한 후, 각 군별로 9개씩 총 45개의 slide를 제작하여 400배율의 시야에서 광학현미경(Nikon, Japan)으로 측정하였다.
6) Enzyme-Linked Immunosorbent Assay(ELISA)
BALF 내 TNF-α, IL-17, MIP2의 발현량 측정을 위해 ELISA를 수행했다. Capture antibody와 coating buffer를 혼합하여 각 well에 100 μl씩 첨가하고, 4 ℃를 유지하여 하룻밤 둔 다음, washing buffer로 4회에 걸쳐 세척하였다. 각각의 well에 assay diluent 200 μl씩을 넣고, 실온에서 blocking을 1시간 동안 한 다음, washing buffer로 4회에 걸쳐 세척하였다. 다음으로 capture antibody가 코팅된 96 well plate에 각 실험군의 standard 100 μl과 혈청을 넣고 2시간 동안 실온에서 반응시켰다. 이후 washing buffer로 3회 세척한 뒤, 각 well에 biotin-conjugate antibody reagent 100 μl을 처리한 다음, 실온에서 1시간 동안 반응시켰다. 이후 washing buffer로 2회 세척한 후, streptavidin-HRP solution 100 μl을 각 well에 처리하여 실온에서 1시간 동안 반응시킨 후, washing buffer로 2회에 걸쳐 세척하였다. 이어 substrate solution 100 μl을 첨가하여 20분간 반응시킨 후, stop solution 50 μl을 이용하여 반응을 종결시킨 다음, 450 nm 파장에서 흡광도를 측정하였다.
7) Real-time Polymerase chain reaction(PCR) 분석
폐조직에서 TNF-α, IL-17, MIP2, TRPV1 mRNA의 발현 수준을 측정하기 위해 real-time PCR을 수행하였다. 생쥐의 폐조직을 적출해 RN7) Azol (CS-105B, Tel-Test, USA) 500 ml를 첨가한 뒤 용해될 때까지 분쇄하였다. 이후 혼합 부유액에 chloroform (CHCl3) 50 ml을 첨가하고 15초간 혼합한 후, 얼음에 15분간 방치한 다음, 13,000 rpm으로 원심분리하여 상층액 약 200 ml을 분리하였다. 이 상층액에 2-propranol 200 ml를 혼합하여 흔들어준 뒤, 15분간 얼음에 방치한 다음, 13,000 rpm으로 원심분리하였다. 이어서 80% EtOH로 세척한 다음, 3분 동안 vacuum pump(ULVAC, USA)로 건조시켜 RNA를 추출하였다. 추출한 RNA를 diethy pyrocarbonate (DEPC, IBS-BW1004, Intron, Korea)로 처리된 증류수 20 ml에 녹인 다음, block heater(2050, Lab-Line, India)에서 75 ℃로 불활성화한 다음 first cDNA 합성에 사용하였다. 역전사 반응을 위해 2 μg의 total RNA와 DNase I(10 U/ml) 2 U/tube를 37 ℃의 heating block에서 30분 동안 반응시킨 후 75 ℃에서 10분간 변성시켰다. 이후 10 mM dNTP Mix(4026, 4027, 4028, 4029, TaKaRa, Japan) 2.5 ml 및 100 mM DTT(P1171, Promega, USA) 1 ml, 5x reaction buffer(M531A, Promega, USA) 4.5 ml를 첨가하고, M-MLV RT(M1705, Promega, USA) 1 ml를 추가한 다음, DEPC로 처리된 증류수를 더하여 최종 부피가 20 μl 되도록 조정하였다. 위의 반응 혼합액 20 μl를 2,000 rpm으로 5초간 원심 침강시키고, 37 ℃의 block heater에서 60분 동안 반응시켜서 first-strand cDNA를 합성시킨 후, 95 ℃에 5분간 방치하여 M-MLV RT를 불활성화시켜서 합성을 완료한 cDNA를 real-time PCR에 사용하였다.
합성한 cDNA는 Power SYBR Green PCR Master Mix(ABi, USA)와 Applied Biosystems 7500 Fast Real-Time PCR system(Applied Biosystems, USA)을 사용하여 실시간 PCR을 수행하였고, mouse glyceraldehyde-3-phosphate dehydrogenase(G3PDH) cDNA probe(Applied Biosystems, USA)를 대조군으로 사용했다. Probe의 primer 및 sequence는 Table 2에 제시하였으며, Taqman PCR Master mix를 반응액으로 사용하였고, probe의 최종농도가 200 nM이 되도록 반응시켰다. Real time quantitative PCR 조건에서 pre-denaturation은 50 ℃로 2분, 94 ℃로 10분, 40 cycles를 95 ℃로 15초, 60 ℃로 1분 수행하였다. 내부표준으로는 G3PDH를 사용하였다. Relative quantitative(RQ)는 target group의 Quantitative PCR y=x(1+e)n로 계산하였다(y=yield, x=starting quantity, e=efficiency, n=number of cycles).
8) BALF 내 면역세포 유세포 분석(flow cytometry analysis)
분리한 BALF 및 폐조직의 세포들을 5×105개로 조정한 후 4 ℃에서 면역 형광염색(immunofluorescence staining)을 실시하였다. 각각에 BD Pharmingen 사(San Diego, CA, USA)의 PE-anti-CD4(553047), PE-anti-CD8(553033), PE-anti-Gr-1(553128), FITC Rat anti-CD69(552879), FITC Rat anti-mouse CD21/CD35(553818), PE Rat Anti-mouse CD62L (553151), PE Rat Anti-mouse CD44(553135), PE-anti-Siglec-F(562068)을 넣고 30분간 얼음에서 반응시켰다. 이후 3회에 걸쳐 인산완충 생리식염수로 수세한 뒤, 세포의 분포 비율(%)을 flow cytometer의 Cell Quest 프로그램(BD Biosciences, San Diego, CA, USA)을 이용하여 분석하고, 총세포수(total cells)를 기준으로 하여 절대 세포수(absolute number)를 도출하였다.
9) Hematoxylin & Eosin과 Masson’s trichrome 염색
H&E 염색과 M-T 염색으로 폐의 손상 정도를 평가하기 위해 구조(structure)와 관련하여 폐포(alveolar) 및 세기관지(bronchiole)의 형태와 혈액 세포의 침윤 정도를 확인하였다. 10% neutral buffered formalin에 폐조직을 24시간을 고정시킨 다음, graded alcohol로 탈수시켰다. 이후 파라핀에 포매하여서 block을 제작한 후, microtome을 사용하여 4 μm 두께의 조직 절편을 만들었다. 이후 H&E 염색을 위해 슬라이드를 1분 동안 hematoxylin에 담갔다가 흐르는 증류수에 여러 번 세척하고, 30초간 eosin에 담갔다가 다시 흐르는 증류수에 여러 번 세척하였다. 이어서 70%→95%→100%의 순서로 ethanol로 여러 번 세척하여 적절한 정도로 염색을 제거한 후 1분간 xylene에 담가두었다. 이후 mounting medium xylene을 사용하여 영구적으로 cover-slide를 부착시킨 다음 광학현미경(Nikon, Japan)으로 200배율에서 관찰하였다. Masson’s trichrome 염색을 실시하기 위해 두께 4 μm의 절편을 제작하고 탈 파라핀, 함수, 세척 과정을 거친 후, Bouin 용액 56 ℃에서 1시간 동안 매염처리 후 세척한 다음, Weigert’s iron hematoxylin 용액으로 10분간 수세하였다. 이어서 Biebrich scarlet-acid fuchsin 용액으로 5분간 염색한 후 세척하고, phosphomolybdic phosphotungstic acid 용액을 이용하여 15분간 분별 염색한 다음 5분간 aniline blue 용액에서 염색하였다. 다음으로 0.5% glacial acetic acid 용액에서 감별을 3분간 하고 탈수와 청명 과정을 거친 다음, 영구적으로 cover-slide를 부착시켜 광학현미경(Nikon, Japan)으로 200배율에서 관찰하였다. 폐손상 정도를 위한 조직학적 분석 점수 산출은 Tanaka 등18의 방법을 응용하여 폐포 및 세기관지 구조의 손상 정도, 콜라겐 침착 정도, 혈구세포 및 염증세포의 침윤 정도의 5개 항목을 3점 척도(0-2)로 평가하여 수행하였다.
10) Grip strength 측정
근력 평가는 교차 그물망에 매달리는 시간을 측정하여 이를 통해서 사지의 근력을 평가하였다. 실험쥐들의 원위부 근력을 검사하기 위하여 grip strength meter를 사용하였다. 설치류들은 후방에서 잡아당겨지면 본능적으로 눈앞의 물체를 붙잡는 경향이 있다. 측정 장비는 mouse에게 힘 변환기(force transducer)가 연결된 막대기(bar)를 붙잡게 한 후 mouse의 꼬리를 후방으로 조심스럽게 잡아당기면, mouse가 버티지 못하고 막대기를 놓치게 되는 순간을 최대 악력으로 기록되도록 고안되었다. 측정방법은 실험자가 부드럽게 mouse의 몸통과 꼬리를 잡고 바닥보다 10 cm 위에 설치된 근력측정기의 막대기를 잡도록 유도한 후, 일정한 속도로 꼬리를 뒤로 잡아당겨서 mouse의 양쪽 앞발을 모두 놓을 때까지 수행하였다. 신뢰도를 높이기 위해 총 3회 측정하여 최고값을 기록하여 사용하였고, 각 측정 간에는 20분의 충분한 휴식시간을 두었다. Grip strength 측정은 기존 연구를 참고하여 실험이 종료되기 이전인 26일 차에 시행하였다19.
11) Treadmill 운동 시간 측정
지구성 능력은 에너지 전환능력, 호흡, 순환, 혈액 등의 산소운반 능력이나 조직의 산소이용기능이 관여하고 있으며, 전신의 지구력과 관련이 있다. 지구성 능력의 평가는 treadmill 검사를 통해 수행하였고, mouse가 3회 멈추었을 때 시간을 측정하였다. 소형동물용 treadmill을 이용하여 초기 1분은 경사도 0%에서 6 m/min의 속도로 적응을 시킨 다음 15분간 8 m/min의 속도로 15분간 측정하였다. 신뢰도를 높이기 위해 총 3회 측정하여 평균값을 기록하여 사용하였고, 각 측정 간에는 20분의 충분한 휴식시간을 두었다. Treadmill 운동 시간 측정은 CSE와 LPS가 근육 기능에 미치는 영향을 조사함과 동시에 쌍화탕의 근육 기능 회복 또한 평가하기 위함으로, CSE와 LPS의 유도가 끝나고 48시간 내에 측정하도록 설계하였으며 기존 실험들을 반영하고 변형하여, 유도된 근위축이 있는 mouse에 쌍화탕을 처리하고 23일차에 근 기능을 평가하였다20.
12) 근육조직의 Hematoxylin & Eosin과 PTAH 염색
Mouse의 대퇴사두근에서 분리한 근육 샘플을 파라핀에 고정하여 박리한 절편을 hematoxylin 용액에 5분, 증류수에 5분, eosin 용액에 30초 담근 후 건조하여 고정하였다. 또한 박리한 절편을 5분 동안 1% 과망간산 칼륨(potassium permangante) 수용액에 처리한 뒤, PBS로 3회 세척하고 24시간 동안 phosphotungstic acid hematoxylin(PTAH) 용액에서 처리한 다음 투명 봉입하였다. 각각의 절편은 광학현미경(Nikon, Japan)으로 100배율에서 관찰하였다.
13) 통계분석
각각의 실험으로부터 얻은 데이터는 mean±standard error of mean(SEM)으로 기록하였고, 그룹 간 비교는 독립표본 T검정으로 분석하였고 SPSS software (ver. 12.0, SPSS Inc., USA)를 사용하였다. 통계적 유의성은 P value가 0.05보다 작은 경우를 기준으로 하였고, 다시 0.05, 0.01 및 0.001보다 작은 경우로 구분하였다.
III. 결 과
1. BALF 내 neutrophil 증가에 미치는 영향
COPD가 유발된 대조군에서 neutrophil은 81,67± 11.21개로 나타나 정상군의 1.33±0.88개보다 유의한 증가를 보였으며, dexamethasone을 처리한 양성대조군은 25.67±9.95개, SHT 250 mg/kg을 투여한 실험군은 24.33±6.02개, 500 mg/kg을 투여한 실험군은 10.33±3.18개로 나타나 대조군에 비하여 모든 농도에서 유의하게 감소하였다(Fig. 2).
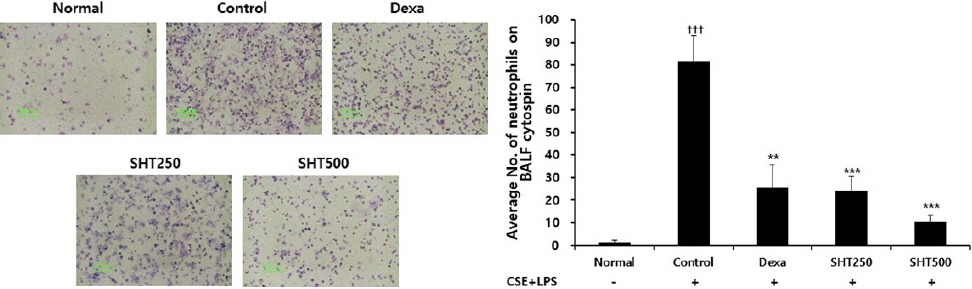
Effect of SHT on (A) cytospin image of neutrophils and (B) absolute number of neutrophils in BALF of COPD mice.
Mice were injected intranasally with CSE+LPS (Control), and then treated with Dexa (dexamethasone 3 mg/kg) and SHT (250, 500 mg/kg) for 28 days (n=4). All values are mean±standard error. † : Significantly different from the Normal (††† p<0.001), * : Significantly different from the Control (** p<0.01, *** p<0.001).
2. BALF 및 폐조직 내 면역세포 활성에 미치는 영향
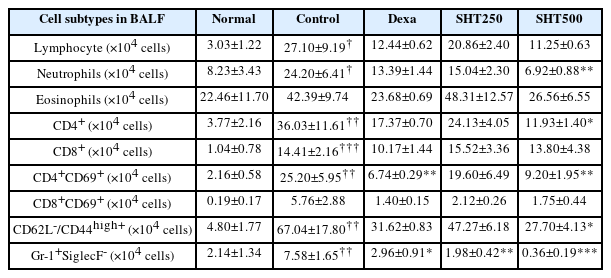
COPD를 발생시킨 동물모델에서 BALF의 면역세포 활성에 대하여 FACS 분석을 시행한 결과, neutrophil, CD4+, CD4+/CD69+, CD62L-/CD44high+ 세포는 SHT 500 mg/kg 투여군에서 대조군보다 유의성 있게 감소하였으며, Gr-1+/siglecF- 세포는 SHT의 모든 농도에서 대조군보다 유의성 있게 감소하였다(Table 3).
폐조직의 면역세포 활성에 대하여 FACS 분석을 시행한 결과, neutrophil, eosinophil, CD4+ 세포는 SHT 500 mg/kg 투여군에서 대조군보다 유의성 있게 감소하였고, CD8+, CD4+/CD69+, CD8+/CD69+, CD62L-/CD44high+, CD21+/B220-, Gr-1+/siglecF- 세포는 SHT의 모든 농도에서 대조군보다 유의성 있게 감소하였다(Table 4).
3. BALF 내 cytokines 생성에 미치는 영향
1) TNF-α 생성에 미치는 영향
COPD가 유발된 대조군의 TNF-α는 475.77±18.72 pg/ml로 나타나 정상군의 244.52±14.91 pg/ml보다 유의하게 증가하였고, dexamethasone을 처리한 양성대조군은 249.36±13.25 pg/ml, SHT 250 mg/kg을 투여한 실험군에서는 341.06±19.54 pg/ml, SHT 500 mg/kg을 투여한 실험군에서는 395.39±40.24 pg/ml로 나타나 SHT 250 mg/kg 투여에서 대조군에 비하여 유의하게 감소하였다(Fig. 3A).
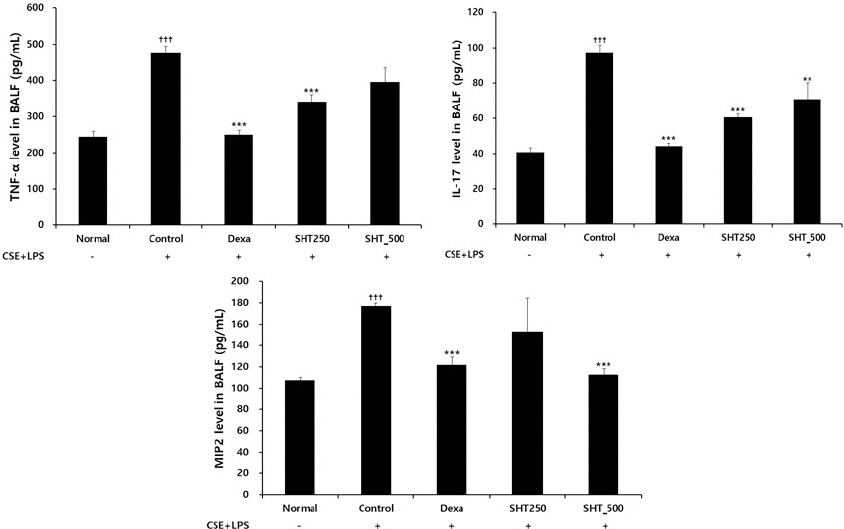
Effect of SHT on (A) TNF-α, (B) IL-17, and (C) MIP2 production in BALF of COPD mice.
Mice were injected intranasally with CSE+LPS (Control), and then treated with Dexa (dexamethasone 3 mg/kg), SHT250 (250 mg/kg) and SHT500 (500 mg/kg) for 28 days (n=4). Levels of TNF-α, IL-17, and MIP2 were determined using ELISA. All values are mean±standard error. † : Significantly different from the Normal (††† p<0.001), * : Significantly different from the Control (** p<0.01, *** p<0.001).
2) IL-17 생성에 미치는 영향
COPD가 유발된 대조군의 IL-17는 97.23±4.46 pg/ml로 나타나 정상군의 40.78±2.37 pg/ml보다 유의하게 증가하였으며, COPD를 유발하여 dexamethasone을 처리한 양성대조군은 44.21±1.72 pg/ml, SHT 250 mg/kg을 투여한 실험군에서는 60.60±1.97 pg/ml, SHT 500 mg/kg을 투여한 실험군에서는 70.93±9.22 pg/ml로 나타나 SHT를 투여한 모든 실험군에서 대조군에 비교하여 유의하게 감소하였다(Fig. 3B).
3) MIP2 생성에 미치는 영향
COPD가 유발된 대조군의 MIP2는 177.10±2.64 pg/ml로 나타나 정상군의 107.83±2.63 pg/ml보다 유의하게 증가하였으며, COPD를 유발하여 dexamethasone을 처리한 양성대조군은 121.80±7.66 pg/ml, SHT 250 mg/kg을 투여한 실험군에서는 153.35±31.03 pg/ml, SHT 500 mg/kg을 투여한 실험군에서는 113.08± 5.28 pg/ml로 나타나 SHT 500 mg/kg 투여에서 대조군에 비하여 유의하게 감소하였다(Fig. 3C).
4. 폐조직 내 cytokine mRNA 발현에 미치는 영향
1) TNF-α mRNA 발현에 미치는 영향
COPD가 유발된 대조군의 TNF-α mRNA Relative Quantitive(RQ)는 2.44±0.58로 나타나 정상군의 0.70±0.21보다 증가하였으며, COPD를 유발한 다음 dexamethasone을 처리한 양성대조군은 0.88±0.32 pg/ml, SHT 250 mg/kg을 투여한 실험군에서는 1.70±0.97 pg/ml, SHT 500 mg/kg을 투여한 실험군에서는 1.03±0.33 pg/ml로 나타나 SHT 500 mg/kg 투여에서 대조군에 비하여 유의하게 감소하였다(Fig. 4A).
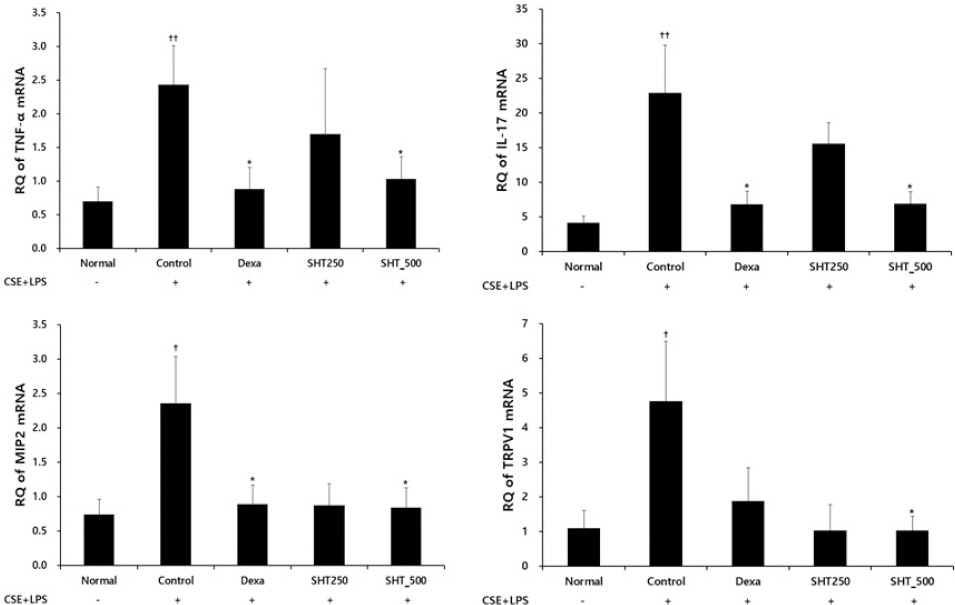
Effect of SHT on (A) TNF-α, (B) IL-17, (C) MIP2, and (D) TRPV1 mRNA expression in lung tissue of COPD mice.
Mice were injected intranasally with CSE+LPS (Control), and then treated with Dexa (dexamethasone 3 mg/kg), SHT250 (250 mg/kg) and SHT500 (500 mg/kg) for 28 days (n=4). Levels of TNF-α, IL-17, MIP2, and TRPV1 were determined using real time PCR. All values are mean±standard error. † : Significantly different from the Normal († p<0.05, †† p<0.01), * : Significantly different from the Control (* p<0.05).
2) IL-17 mRNA 발현에 미치는 영향
대조군의 IL-17 mRNA Relative Quantitive(RQ)는 22.92±6.91로 나타나 정상군의 4.12±0.97보다 증가하였으며, COPD를 유발한 다음 dexamethasone을 처리한 양성대조군은 6.86±1.85 pg/ml, SHT 250 mg/kg을 투여한 실험군에서는 15.57±3.08 pg/ml, SHT 500 mg/kg을 투여한 실험군에서는 6.88±1.73 pg/ml로 나타나 SHT 500 mg/kg 투여에서 대조군에 비하여 유의하게 감소하였다(Fig. 4B).
3) MIP2 mRNA 발현에 미치는 영향
대조군의 MIP2 mRNA Relative Quantitive(RQ)는 2.36±0.68로 나타나 정상군의 0.74±0.23보다 증가하였으며, COPD를 유발한 다음 dexamethasone을 처리한 양성대조군은 0.89±0.28 pg/ml, SHT 250 mg/kg을 투여한 실험군에서는 0.87±0.32 pg/ml, SHT 500 mg/kg을 투여한 실험군에서는 0.84±0.29 pg/ml로 나타나 SHT 500 mg/kg 투여에서 대조군에 비하여 유의하게 감소하였다(Fig. 4C).
4) TRPV1 mRNA 발현에 미치는 영향
대조군의 MIP2 mRNA Relative Quantitive(RQ)는 4.77±1.73로 나타나 정상군의 1.10±0.52보다 증가하였으며, COPD를 유발한 다음 dexamethasone을 처리한 양성대조군은 1.88±0.96 pg/ml, SHT 250 mg/kg을 투여한 실험군에서는 1.02±0.76 pg/ml, SHT 500 mg/kg을 투여한 실험군에서는 1.03±0.41 pg/ml로 나타나 SHT 500 mg/kg 투여에서 대조군에 비하여 유의하게 감소하였다(Fig. 4D).
5. 폐조직 손상의 조직학적 변화에 미치는 영향
정상군의 폐조직에서는 크기가 작고 균일한 형태의 폐포가 관찰되었으나, COPD가 유발된 대조군에서는 폐포의 크기가 균일하지 않으면서 기도벽의 비후가 나타났으며, 폐포 주변으로 세포 침착이 증가한 것이 관찰되었다. Dexamethasone을 처리한 양성대조군에서는 비교적 균일하게 폐포의 형태가 유지되었고, SHT를 투여한 실험군에서는 세포 침착 현상이 폐포 주변에서 관찰되었으나 대조군에 비해 상대적으로 폐포 형태가 비교적 균일하게 유지되는 것이 관찰되었으며 고농도에서 더욱 현저하였다(Fig. 5A). 폐조직의 손상 정도를 점수화하여 정량적으로 평가한 결과, 대조군은 11.33 ±0.32로 측정되어 정상군의 2.00±0.49보다 유의하게 증가하였으며, 양성대조군은 5.67±0.54로 유의성 있게 감소하였다. SHT 250 및 500 mg/kg를 각각 투여한 실험군은 8.33±0.61, 7.33±0.55로 나타나 대조군에 비교하여 유의하게 감소하였다(Fig. 5B).
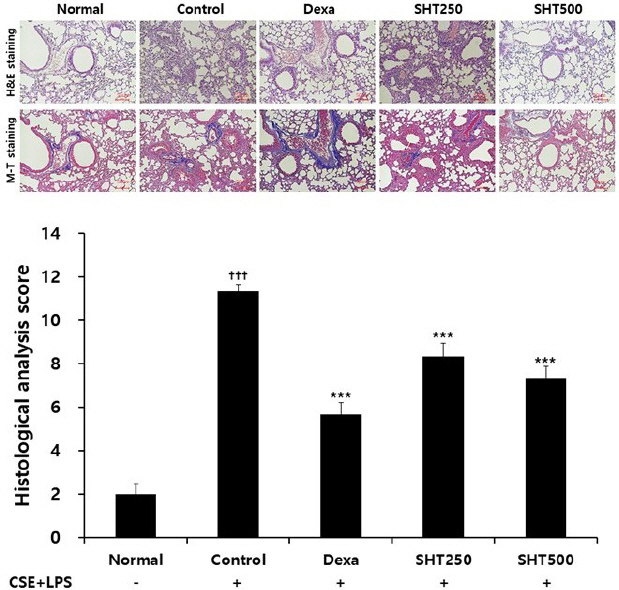
Effect of SHT on histophathological changes in the lung of CSE+LPS-induced COPD mice.
Mice were injected intranasally with CSE+LPS (Control), and then treated with Dexa (dexamethasone 3 mg/kg), SHT250 (250 mg/kg) and SHT500 (500 mg/kg) for 28 days (n=4). (A) Representative sections of lung stained with H&E stain and M-T stain. Image from light microscope at 100× magnification. (B) Quantitative evaluation of the degree of lung tissue damage in the sections. All values are mean±standard error. † : Significantly different from the Normal (††† p<0.001), * : Significantly different from the Control (*** p<0.001).
6. Grip strength에 미치는 영향
대조군의 grip force(gf)는 109.34±4.71로 나타나 정상군의 129.21±3.99보다 감소하였으며, COPD를 유발한 다음 dexamethasone을 처리한 양성대조군은 108.05±5.94, SHT 250 mg/kg을 투여한 실험군에서는 129.61±3.89, SHT 500 mg/kg을 투여한 실험군에서는 126.26±3.22로 나타나 대조군에 비하여 유의하게 증가하였다(Fig. 6A).
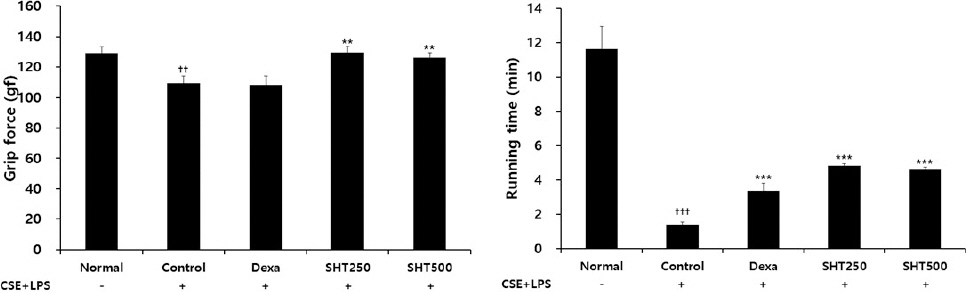
Effect of SHT on (A) grip strength and (B) running time of COPD mice.
Mice were injected intranasally with CSE+LPS (Control), and then treated with Dexa (dexamethasone 3 mg/kg), SHT250 (250 mg/kg) and SHT500 (500 mg/kg) for 28 days (n=4). Grip force was determined using grip strength meter. Running time was determined using treadmill exercise. All values are mean±standard error. † : Significantly different from the Normal (†† p<0.01, ††† p<0.001), * : Significantly different from the Control (** p<0.01, *** p<0.001).
7. Treadmill 운동 시간에 미치는 영향
대조군의 running time(min)은 1.39±0.16으로 나타나 정상군의 11.64±1.31보다 감소하였으며, COPD를 유발한 다음 dexamethasone을 처리한 양성대조군은 3.36±0.45, SHT 250 mg/kg을 투여한 실험군에서는 4.84±0.13, SHT 500 mg/kg을 투여한 실험군에서는 4.62±0.12로 나타나 대조군에 비하여 유의하게 증가하였다(Fig. 6B).
8. 근육 손상의 조직학적 변화에 미치는 영향
근단면적을 측정하기 위해 H&E 및 PTAH 염색을 실시한 결과, 정상군에서는 건 섬유들이 건을 형성하여 치밀하게 차 있었으며 섬유모세포들이 콜라겐 섬유들의 결을 따라 질서 정연하게 배열되어 있는 것이 관찰되었다. COPD가 유발된 대조군에서는 건을 구성하는 건 섬유들의 소실이 나타나 섬유의 밀도가 감소하였으며, 건 섬유결의 소실과 섬유모세포들의 수적 감소가 관찰되었다. 또한 섬유모세포들의 배열도 정상군에 비해 불규칙적으로 연관성 없이 나타났으며, 군데군데 모여 있는 것 또한 관찰되었다. SHT 250 및 500 mg/kg 투여군에서는 건 섬유의 밀도가 일부 감소하였으나 짧으면서 끝이 뾰족한 모양(small and stick-like shape)을 한 다수의 섬유모세포들이 비교적 줄지어 배열하고 있는 것이 관찰되었다(Fig. 7).
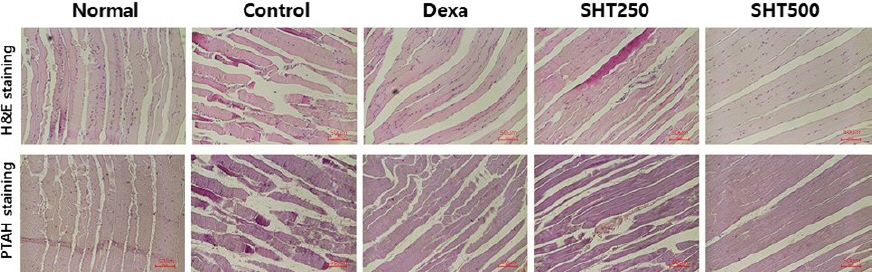
Effect of SHT on histophathological changes in the quadriceps muscle of CSE+LPS-induced COPD mice model.
Mice were injected intranasally with CSE+LPS (Control), and then treated with Dexa (dexamethasone 3 mg/kg), SHT250 (250 mg/kg) and SHT500 (500 mg/kg) for 28 days (n=4). Representative sections of quadriceps muscle stained with H&E stain and PTAH stain. Image from light microscope at 100× magnification.
IV. 고 찰
전 세계적으로 높은 유병률과 사망률을 나타내는 COPD는 이로 인하여 개인적 생활능력의 감소뿐만 아니라 큰 사회경제적 부담을 초래하고 있다21. COPD의 유병률에 대해서는 2019년 기준으로 전 세계에 약 2억 9천만 명의 환자가 있는 것으로 추정되었고22, 우리나라의 경우는 2015년부터 2019년까지의 국민건강영양조사 자료 분석에 따르면 전체 유병률이 12.9%에 이르는 것으로 나타났다23.
COPD 환자는 소기도와 폐실질뿐만 아니라 근위부의 중심기도와 폐혈관계를 비롯한 폐의 각 부위에서 염증 세포에 의한 염증 변화와 이에 따른 손상과 복구 작용의 반복하여 발생하고 이로 인해 기도의 구조적 변화가 일어난다24. 즉 neutrophil, macrophage, CD8+ 세포와 같은 림프구들이 활성화되면 proinflammatory cytokines, chemotactic factors, growth factors 등의 다양한 염증매개물질을 분비하여 혈액 내 염증세포들을 폐로 불러 모으고 지속적인 염증반응을 일으킨다25. 이러한 염증반응의 과정에서 염증세포와 기도상피세포는 단백분해효소를 분비하고 항단백분해효소를 감소시켜 폐실질 결합조직의 주요성분인 엘라스틴을 파괴하여 폐기종을 초래한다26.
근감소증은 근육량의 감소에 더하여 근력 및 신체 기능의 저하로 정의되는데27, COPD 환자의 27.5%가 근감소증을 동반하고28, 연령, 기류제한의 정도 및 질환의 중증도에 따라 증가한다29. COPD 환자의 골격근 기능장애는 호흡근과 비호흡근 모두에 영향을 미치고, 상지 근육에 비해 대퇴사두근과 같은 하지 근육에서 더 심각하며 이는 환자의 보행 능력을 저하시키고 일상생활에 심해한 영향을 미친다30. COPD 환자의 근감소증은 기류 폐쇄, 폐기종 및 호흡곤란의 중증도, 사망률 증가와 관련이 있는 것으로 보고되고 있다31.
본 연구의 대상인 쌍화탕의 구성 약물 중 백작약, 숙지황, 당귀, 천궁은 사물탕의 구성으로 macrophage에서 TNF-α 분비와 NO 생성을 감소시키고 phagocytic activity를 증가시키는 효과가 있고32, 황기는 과도 운동에 의한 스트레스 호르몬 분비 및 이에 따른 cytokine 농도 변화를 회복시키며33, 감초는 진해 효과34와 천식 동물모델 및 폐렴 모델에서의 효과가 보고되었고35,36, 생강은 천식 동물모델에서의 Th2 면역반응을 감소시키며37, 대조는 항산화 활성, 항염증 작용 및 근력 강화 작용이 있는 것으로 알려졌다38. 이와 같은 구성약물의 선행 연구 효능을 고려할 때 COPD에서도 유효한 결과를 얻을 가능성이 높을 것으로 기대하였다.
효능 평가를 위한 COPD 동물모델에서 elastase7, LPS11 등의 방법으로 폐손상을 유도하는 방법이 사용되어 왔다. 본 연구에서는 COPD의 가장 주요한 발병 인자인 흡연 자극을 개별 동물에 균일하게 유발시킬 수 있도록 양 등8,10의 방법을 응용하여 C57BL/6 생쥐의 기도 안으로 LPS와 표준담배 추출물인 CSE를 흡인시키는 방법을 폐손상을 유도한 다음 쌍화탕의 효과를 평가하였다. 또한 폐손상 관련 지표뿐만 아니라 COPD 환자의 삶의 질과 예후에 밀접한 관련이 있는 근감소에 대한 쌍화탕의 영향을 평가하고자 하였다.
먼저 COPD 동물모델에서 분리한 BALF에서 neutrophil의 증감을 cytospin으로 분석한 결과, 대조군에서는 neutrophil이 유의하게 증가하였고 쌍화탕을 투여한 실험군에서는 유의한 감소를 보였다. COPD를 유발한 대조군의 BALF에서 neutrophil의 증가가 유도된 것은 기존 연구들8-10에서 관찰된 결과와 일치하였다. 증가된 neutrophil은 COPD 환자에서 기류제한으로 인한 폐기능 감소의 진행을 촉진하고32, COPD의 급성악화에서 기도염증을 증가시키는 역할을 하는 것으로 알려져 있다33. 따라서 쌍화탕은 COPD의 병리기전 중 주요한 역할로 생각되는 neutrophil의 증가를 감소시킴으로써 COPD의 진행과 기도염증을 억제하는데 관여할 수 있을 것으로 생각된다.
다음으로 BALF와 폐조직에서 면역세포의 발현 양상을 FACS를 통해 분석한 결과, 쌍화탕 투여가 lymphocyte, neutrophil, eosinophil, CD4+, CD8+, CD4+CD69+, CD8+CD69+, CD62L-CD44high+, CD21+B220+, Gr-1+SiglecF-와 같은 면역세포 아형의 발현을 억제하였다. Siglec-F(mouse sialic acid-binding immunoglobulin -like lectin F)는 eosinophil의 표면 수용체로 알려져 있는데39 Siglec-F-는 mouse 과립구에서 neutrophil의 구분을 위한 marker로 이용되고40, CD11b+/Gr-1+는 과립구 특이 세포 표면 단백질로 히스타민과 같은 알레르기 매개인자들의 분비를 유발함으로써 IL-4, IL-5, IL-13 등의 cytokine 생성에 관여하여 염증 악화의 요인으로 작용한다41. COPD의 병리에서 주요한 역할을 하는 세포인 CD4+ T 세포가 활성화되면 CD44high와 CD62L-이 나타나는데 COPD에서 혈중 neutrophil은 하향 조절된 CD62L의 발현으로 표현형을 확인할 수 있고42, CD44는 lymphocyte가 염증 부위로 이동하는 과정에 필수적 역할을 한다43. CD8+ 세포는 무증상 흡연자 또는 COPD를 동반한 흡연자에서 증가하는데44 이러한 증가는 COPD 환자의 하기도에 세균 집락이 생길 수 있음을 시사한다45. CD69는 급성 활성화의 marker로서 CD69를 발현하는 폐 CD8+ T 세포의 분율은 COPD의 중증도에 따라 증가하는 상관관계를 갖는다46. 쌍화탕이 BALF와 폐조직에서 면역세포들의 발현을 억제하는 것은 쌍화탕이 COPD의 면역세포 매개 병리적 면역반응에 대해 작용할 수 있음을 나타낸다.
COPD를 유도한 동물모델의 BALF를 수집하여 ELISA 및 PCR 검사를 시행한 결과, 정상군과 비교하여 대조군의 TNF-α 및 IL-17A는 유의하게 증가하였으며, 쌍화탕을 투여한 실험군에서는 대조군과 비교하여 유의하게 감소하였다. COPD 환자의 객담에서 TNF-α는 증가를 보이고47, 악액질과 골격근 손실을 동반한 중증 COPD 환자의 혈청에서 증가된 모습을 보인다44. IL-17는 neutrophil의 생존 기간을 연장시키고48, 장기 흡연자의 말초기도에 neutrophil이 축적되는데 관여한다49. 따라서 쌍화탕은 이러한 관련 염증 cytokine들을 조절함으로써 neutrophil이 매개된 염증을 제한하는 효과를 나타내는 것으로 사료된다. 또한 쌍화탕 투여는 MIP2의 증가를 억제하는 결과를 보였는데 MIP2는 주로 macrophage로부터 분비되는 chemokine으로서 주로 neutrophil을 포함한 염증 및 면역세포가 특정 부위로 모이도록 유도하는 것으로 알려져 있어50 이와 같은 결과는 쌍화탕이 이들 chemokine의 발현을 감소시켜 기도로 염증세포가 이동하는 것에 대한 억제 작용을 할 가능성을 시사한다. 쌍화탕 투여는 TRPV1의 발현을 억제하는 결과를 보였는데 TRPV1은 감각 구심신경의 말단에서 기침반사의 민감성을 증가시키는데 캡사이신, 온도, 산(acid), bradykinin, archidonic-acid derivatives 등 다양한 염증성 매개물질에 의해 활성화된다51. 쌍화탕은 TRPV1의 발현을 억제함으로써 COPD의 주요 증상 중의 하나인 기침을 억제하는 작용을 나타낼 수 있을 것으로 생각된다.
COPD 동물모델의 폐조직에 대한 H&E staining 및 M-T staining을 통한 조직학적 분석에서 정상군의 폐포들은 일정한 크기로 균일한 형태를 유지하는 것으로 관찰되었으나, 대조군에서는 다수의 확장된 폐포들이 관찰되어 균일한 형태는 아니었으며, 기도벽의 비후, 콜라겐 침착 및 다수의 염증세포들이 소기도 주변에 침윤된 것이 관찰되었다. 이러한 변화는 COPD의 병태생리에서 주로 기류제한이 발생하는 위치인 2 mm 이하 소기도에서 폐포의 비정상적인 영구적 확장과 기도벽의 섬유화 등의 비가역적인 내경 감소를 반영한다52. 쌍화탕을 투여한 실험군에서는 염증세포의 침윤이 감소되었고 폐포의 형태 및 크기가 균일한 것을 관찰할 수 있었으며, 조직학적 손상의 정량적 분석 정도가 쌍화탕 투여로 유의하게 감소되는 것으로 나타나 쌍화탕이 폐조직이 손상되는 것을 방어할 수 있음이 확인되었다.
COPD를 유도한 동물모델에서 근력 변화에 대한 쌍화탕의 효능을 파악하기 위하여 교차 그물망에 매달리도록 하고 후방으로 천천히 당겨서 grip strength를 측정한 결과, 대조군에서 정상군에 비하여 유의하게 감소하여 근력 악화를 확인하였고, 쌍화탕을 투여한 실험군에서는 유의하게 증가하는 것으로 나타났다. COPD 환자에서 쉽게 발생하는 사지 근육의 위축과 악화는 신체 활동 참여의 어려움, 운동 불내성(exercise intolerance), 삶의 질 저하, 조기 사망 등 질병의 예후에 중요한 결과를 초래한다53. 따라서 위와 같은 결과는 쌍화탕이 COPD에서 발생하는 근력 감소를 완화하는 작용을 나타낼 수 있음을 시사한다.
COPD를 유도한 동물모델에서 신체수행능력에 대한 쌍화탕의 효능을 평가하기 위하여 treadmill을 이용하여 running time을 측정한 결과, 대조군에서 정상군에 비하여 유의하게 감소하여 신체수행능력의 감소를 확인하였고, 쌍화탕을 투여한 실험군에서는 유의하게 증가하는 것으로 나타났다. COPD 환자는 움직이면 숨이 차서 불안하여 움직이지 않으려고 하고, 이로 인하여 근력이 약화되며, 운동능력이 다시 감소하여 숨이 더욱 차는 악순환을 보인다54. 쌍화탕은 COPD 환자의 운동능력 감소를 완화하여 호흡곤란으로 인한 활동 저하를 줄이는 효과를 나타낼 수 있을 것으로 생각된다.
COPD 동물모델의 대퇴사두근에 대한 H&E 및 PTAH 염색을 통한 조직학적 분석에서 정상군의 건을 형성하고 있는 건 섬유들이 치밀하게 유지되어 섬유모세포들이 질서 정연하게 배열되고 있는 것이 관찰되었으나, 대조군에서는 건 섬유들의 소실과 섬유모세포들의 감소가 관찰되었다. 이러한 변화는 COPD 환자에서 만성염증이 근육 단백질의 저장을 감소시키고 근육 단백질 분해를 증가시켜 골격근의 감소를 초래하는 병리변화를 반영한다55. 쌍화탕을 투여한 실험군에서는 건 섬유모세포의 소실과 불규칙한 배열이 감소하는 것이 관찰되어 쌍화탕 투여가 근손상이 증가하는 것을 억제할 수 있음이 확인되었다.
결과를 종합하면 쌍화탕은 COPD 동물모델에서 면역세포들과 염증 cytokine의 활성을 제한하고, 폐조직이 손상되는 것을 줄이는 폐손상 보호효과와 grip strength 및 running time의 감소를 억제하고 근손상을 줄이는 근감소 억제효과를 통해 COPD에 대한 치료 효과를 보일 것으로 생각된다.
V. 결 론
COPD에 대한 쌍화탕의 효과를 평가하기 위해 CSE와 LPS로 유도한 COPD 동물모델에서 폐손상과 연관된 면역세포 및 cytokine과 폐조직의 조직학적 변화와 근력, 근기능 및 근육조직의 조직학적 변화에 대한 영향을 관찰한 대조군과 비교한 결과 다음과 같은 결론을 얻었다.
1. 쌍화탕 투여군은 대조군에 비해 BALF 내 neutrophil의 증가가 모든 농도에서 통계적으로 유의하게 억제되었다.
2. BALF 내 면역세포 FACS 분석에서 neutrophils, CD4+, CD4+CD69+, CD62L-CD44high+ 세포가 500 mg/kg 투여군에서 대조군에 비해 통계적으로 유의하게 감소하였고, Gr-1+SiglecF- 세포가 쌍화탕 투여군에서 대조군에 비해 모든 농도에서 통계적으로 유의하게 감소하였다.
3. 폐조직의 면역세포 FACS 분석에서 neutrophil, eosinophil, CD4+ 세포가 250 mg/kg 투여군에서 대조군에 비해 통계적으로 유의하게 감소하였고, lymphocyte, CD8+, CD4+CD69+, CD8+CD69+, CD62L-CD44high+, CD21+B220+, Gr-1+SiglecF- 세포가 쌍화탕 투여군에서 대조군에 비해 모든 농도에서 통계적으로 유의하게 감소하였다.
4. BALF 내 TNF-α가 250 mg/kg 투여군에서, IL-17이 500 mg/kg 투여군에서, MIP2가 모든 농도의 쌍화탕 투여군에서 대조군에 비해 통계적으로 유의하게 감소하였다.
5. 폐조직 내 TNF-α, IL-17, MIP2, TRPV1 mRNA 발현이 500 mg/kg 투여군에서 대조군에 비해 통계적으로 유의하게 감소하였다.
6. 쌍화탕 투여군은 모든 농도에서 대조군에 비해 폐조직 손상에 대한 조직학적 분석 점수가 통계적으로 유의하게 감소하였다.
7. COPD가 유발된 mouse에서 쌍화탕 투여군은 모든 농도에서 대조군에 비해 grip strength가 통계적으로 유의하게 증가하였다.
8. COPD를 유발된 mouse에서 쌍화탕 투여군은 모든 농도에서 대조군에 비해 running time 감소가 통계적으로 유의하게 증가하였다.
9. 근손상에 대한 조직학적 분석에서 쌍화탕 투여군은 모든 농도에서 대조군에 비해 손상을 감소시키는 소견을 나타냈다.
이상으로 쌍화탕이 COPD 동물모델에서 면역세포와 염증 cytokine의 조절을 통하여 폐손상을 억제하고 근력 및 근기능의 감소와 근손상을 억제할 가능성을 확인하였다.
감사의 글
이 논문은 2023학년도 대전대학교 교내학술연구비 지원에 의해 연구되었음.